|
|
|
说明:双击或选中下面任意单词,将显示该词的音标、读音、翻译等;选中中文或多个词,将显示翻译。
|
|
|
1) Electricity of valence shell electrons

价层电子电量
2) valence shell

价电子层
3) gross energy of elecerons in the outermost shell orbitals

价层轨道电子总能量
4) valence shell electron

价壳层电子
1.
A novel quantum topological index QTI is proposed based on adjacency matrix by introducing quantum numbers and topological chemical principle on the basis of valence shell electron structure character and interaction among electrons in this paper.
在基态原子价壳层电子隐核图的基础上,基于拓扑化学原理以及原子价壳层电子量子结构特征,构建了原子价壳层电子量子拓扑指数QTI,它对基态原子实现唯一性表征,具有优良的结构选择性。
2.
A novel atom valence shell electron quantum topological index AEI based on topological chemical principle and atom valence shell electron structure character with the help of hidden core graph of ground state atom valence shell electron was proposed in this paper, which appears uniquely to the ground state atom and has excellent structural selectivity.
在基态原子价壳层电子隐核图的基础上,基于拓扑化学原理以及原子价壳层电子结构特征,构建了原子价壳层电子量子拓扑指数(AEI),它对基态原子实现唯一性表征,结合原子价壳层电子平均化能(∑niEi/∑ni)等参数,建立了一套新的元素电负性标度:XN=-0。
3.
A novel connectivity index of valence shell electron energy levels for a ground state atom m VEI (m=0,1,2,.
构建了基态原子价壳层电子能级连接性指数 (mVEI) ,m =0 ,1,2 ,… ,它对基态原子实现唯一性表征 ,其中0 VEI,1VEI对原子具有良好的结构选择性 。
5) valence electron shell

价层电子对
1.
Calculating the number of valence electron shell,we can gain the geometry array of the electron, then judge the geometry configuration of molecule; By the way,the effect on the geometry configuration of molecule and its bond angels are introduced when lone electron pairs exist.
叙述了价层电子对互斥理论的基本规则 ;计算出价层电子对数 ,得到电子几何排布 ,从而判断出分子的几何构型 ;还介绍了孤电子对存在对分子构型及键角的影
6) valence shell electron pair repulsion

价层电子对互斥
1.
On the basis of hybrid orbital theory and valence shell electron pair repulsion (VSEPR) theory that anticipate and judge the configuration of covalent polyatomic molecule or iron(not including complexes),a simple and convenient method to calculate the type of the central atomic hybrid orbital directly is deduced by the valence shell electron pairs.
根据用杂化轨道理论和价层电子对互斥理论预测和判断共价多原子分子或离子 (不包括配合物 )空间构型的原理 ,导出了一种用价层电子对数直接预测中心原子轨道杂化类型的简便方
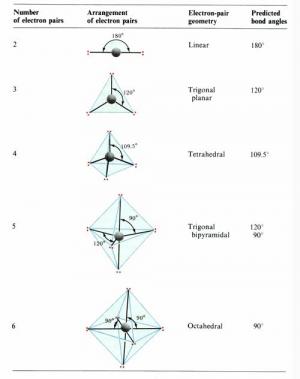
补充资料:价层电子对互斥理论
一个分子的中心原子究竟采取哪种类型的轨道杂化,直接可以预测整个分子的空间构型。 杂化轨道理论成功地解释了部分共价分子杂化与空间构型关系,但是,仅用杂化轨道理论预测有时是难以确定的。1940年美国的sidgwick nv等人相继提出了价层电子对互斥理论(valence shell electron pair repulsion theory),简 称vsepr法,该法适用于主族元素间形成的abn型分子或离子。该理论认为,一个共价分子或离子中,中心原子a周围所配置的原子b(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用。这些电子对在中心原子周围按尽可能互相远离的位置排布,以使彼此间的排斥能最小。所谓价层电子对,指的是形成σ键的电子对和孤对电子。孤对电子的存在,增加了电子对间的排斥力,影响了分子中的键角,会改变分子构型的基本类型。根据此理论,只要知道分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断 abn 型共价分子或离子的空间构型。 价层电子对理论预测分子空间构型步骤为: 1.确定中心原子中价层电子对数 中心原子的价层电子数和配体所提供的共用电子数的总和除以2,即为中心原子的价层电子对数。 规定:(1)作为配体,卤素原子和h 原子提供1个电子,氧族元素的原子不提供电子;(2)作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;(3)对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;(4)计算电子对数时,若剩余1个电子,亦当作 1对电子处理。(5) 双键、叁键等多重键作为1对电子看待。 2.判断分子的空间构型 根据中心原子的价层电子对数,从表9-4中找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型。 实例分析:试判断pcl5 离子的空间构型。 解:p离子的正电荷数为5,中心原子p有5个价电子,cl原子各提供1个电子,所以p原子的价层电子对数为(5+5)/2 = 5,其排布方式为三角双锥。因价层电子对中无孤对电子,所以pcl5 为三角双锥构型。 实例分析:试判断h2o分子的空间构型。 解 :o是h2o分子的中心原子,它有 6个价电子,与o化合的2个h原子各提供1个电子,所以o原子价层电子对数为(6+2)/2 = 4,其排布方式为 四面体,因价层电子对中有2对孤对电子,所以h2o分子的空间构型为v形。 表9-5 理想的价层电子对构型和分子构型 实例分析:判断hcho分子和hcn分子的空间构型 解分子中有1个c=o双键,看作1对成键电子,2个c-h单键为2对成键电子,c原子的价层电子对数为3,且无孤对电子,所以hcho分子的空间构型为平面三角形。 hcn分子的结构式为h—c≡n∶,含有1个c≡n叁键,看作1对成键电子,1个ch单键为1对成键电子,故c原子的价层电子对数为2,且无孤对电子,所以hcn分子的空间构型为直线。
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条
|