1) Mendeleev weighing


门捷列夫称量法
2) Mendeleev
[英][,mende'leief] [美][,mɛndə'leəf, mjɪndɪ'lijɛf]


门捷列夫
1.
On the Inspiration from Mendeleev's Discovering the Periodic Law of Elements


门捷列夫发现元素周期律的启示
3) Mendeleev number


门捷列夫数
1.
The relationship between the types of the binary alloy phase diagrams of Ⅷ and IB group elements with the Mendeleev numbers was discussed for the first time by mean of the Ⅷ group elements as solvent meatals(A) and the IB group elements as solute metals(B), and on bases of their alloy phase diagrams types.
首次讨论了二元合金相图的类型与门捷列夫数 (M)之间的关系。
4) Mendeleev group


门捷列夫族
5) Mendeleev number M


门捷列夫数M
6) Mendeleev's periodic system


门捷列夫周期系
补充资料:门捷列夫
| 门捷列夫(1834~1907) Mendeleev,Dmitri Ivanovich 俄国化学家。1834 年2月7日生于西伯利亚托博尔斯 克,1907年2月2日卒于圣彼得堡 。1850 年入圣彼得堡师范学院学习化学,1855年毕业后任敖德萨中学教师 。1857 年任圣彼得堡大学副教授。1859年他到德国海德堡大学深造。1860年参加了在卡尔斯鲁厄召开的国际化学家代表大会。1861年回圣彼得堡从事科学著 述工作 。 1863 年任工艺学院教 授,1865年获化学博士学位。1866年任圣彼得堡大学普通化学教授,1867年任化学教研室主任。1893年起,任度量衡局局长。1890年当选为英国皇家学会外国会员。
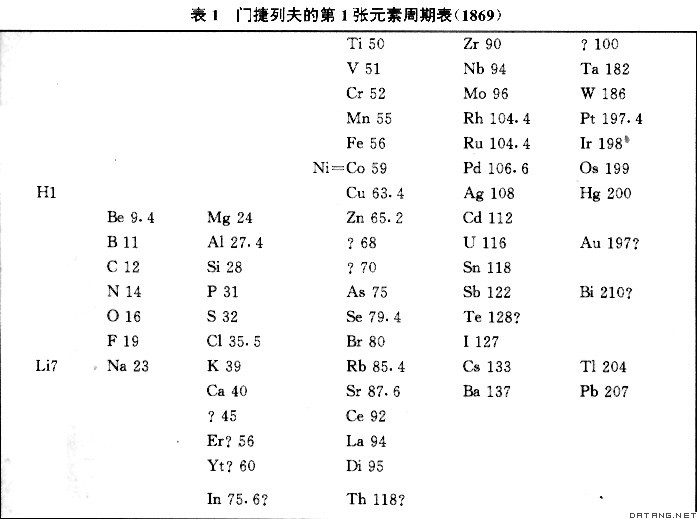
门捷列夫的最大贡献是发现了化学元素周期律。今称门捷列夫周期律。1869年2月 ,门捷列夫编制了一份包括当时已知的全部63种元素的周期表(表1)。同年3月,他委托N.A.缅舒特金在俄国化学会上宣读了题为《元素的属性与原子量的关系》的论文,阐述了元素周期律的要点:①按照原子量的大小排列起来的元素,在性质上呈现明显的周期性。②原子量的大小决定元素的特征。③应该预料到许多未知单质的发现,例如,预料应有类似铝和硅的,原子量位于65~75之间的元素。④已知某些元素的同类元素后,有时可以修正该元素的原子量。 1871年门捷列夫又发表了《化学元素周期性的依赖关系》论文,对化学元素周期律作了进一步阐述。他还重新修订了化学元素周期表( 表2 ) ,把1869 年竖排的表格改为横列,突出了元素族和周期的规律性;划分了主族和副族,使之基本上具备了现代元素周期表的形式。 门捷列夫在发现周期律及制作周期表的过程中,除了不顾当时公认的原子量而改排了某些元素 ( Os、Ir、Pt、Au;Te、I;Ni、Co)的位置外,并且考虑到周期表中合理的位置,修订了其他一些元素(In、La、Y、Er、Ce、Th、U)的原子量,而且预言了一些元素的存在。在1869年的元素周期表中,门捷列夫为4种尚未被发现的元素留下空位 。1871 年他又发表论文 《元素的自然体系和运用它指明某些元素的性质》,对一些元素,例如,类铝 、类硼和类硅的存在和性质以及它们的原子量做了详尽的预言。这样的空位共留下 6 个。门捷列夫的这些推断为后来的化学实验所证实。 元素周期律的发现激起了人们发现新元素和研究无机化学理论的热潮。元素周期律的发现在化学发展史上是一个重要的里程碑,它把几百年来关于各种元素的大量知识系统化起来,形成一个有内在联系的统一体系,进而使之上升为理论。 门捷列夫还曾研究气体和液体的体积与温度和压力的关系,于1860年发现气体的临界温度并提出了液体热膨胀的经验式。1865年研究了溶液的性质,提出了溶液的水合物学说,为近代溶液学说奠定了基础。1872~1882年,他和他的学生准确地测定了数种气体的压缩系数。 门捷列夫因发现周期 律而 获 得英国皇家学会戴维奖章。他还曾获英国科普利奖章。1955年科学家们为了纪念元素周期律的发现者门捷列夫,将 101 号元素命名为钔。门捷列夫运用元素性质周期性的观点写成《化学原理》一书 ,曾被译成英、法等多种文字。
注:?表示未知或未确定
|
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条