1) atomic form factor
原子结构因数
2) atomic structure factor
原子结构因数
3) atom
原子
1.
The calculation of crystal cell parameter, atom amount and crystal-plane's atom auount in nano-cordierite;
纳米级堇青石晶胞参数、原子数和晶面原子数计算与研究
2.
Relationship of crystal ionic radii and atomic number;
晶体离子半径与原子序数的关系
3.
On atom s Transition Probability in the Radiation of Weak Broadband;
弱宽带辐射条件下的原子的跃迁几率
4) Be atom
Be原子
1.
In the present work the polarizability and the hyperpolarizability of Be atom are obtained at the SCF level with basis-set expansion and analytic derivation method.
用基组展开和解析求导的方法精确计算Be原子SCF水平的极化率和超极化率。
5) Atomic
原子
1.
Determination of the contents of eleven metal elements in Folium Isatidis by flame atomic absorption spectro-photometry method;
火焰原子吸收法测定栽培大青叶中11种金属元素含量
2.
Glycine,asparagines,glutamic acid and alanine in sepia were determined by HPLC-AccQ-Tag method and iron was determined by atomic absorption spectrophotometer.
方法:通过黑色素溶于碱性溶液、在酸性环境中有黑色物质析出的性质对黑色素进行定性鉴别,采用HPLC-AccQ-Tag法测定乌贼墨中甘氨酸、天门冬氨酸、谷氨酸和丙氨酸的含量,采用原子吸收分光光度法测定乌贼墨中微量铁元素的含量。
3.
We studied the interaction of two two-level atoms with two mode caving field and discussed the influence of the strength of two mode caving and atomic coupling on the squeezing of field,the ralation between squeezing and the second-order correction degree was revealed.
研究了两个二能级原子与双模场的相互作用 ,用数值计算方法讨论了无关联双模场的强度变化及原子耦合系数大小对场的压缩的影响 ,并给出了场的二阶相干度与压缩的内在联
6) Atoms
原子
1.
Based on several kinds of discrete Hardy spaces which are equivalent with each other,the author discusses their decomposition of atoms.
基于各种等价的离散Hardy空间Hp(Z),进一步讨论其原子分解,定义离散Hardy空间Hp,q,s0(Z)(0
7) ∑-atom
∑-原子
8) A-atom
A-原子
9) atmospheric atom
原子
10) muonic atom
原子
补充资料:原子结构
| 原子结构 atomic structure 原子由原子核和核外电子构成,原子核内有质子、中子,还有其他基本粒子。这里所说的原子结构不包括原子核的结构。 1879年英国W.克鲁克斯首创阴极射线管,提供了打开原子内部构造的工具。阴极射线管能产生一股粒子流,它能推动风车前进,能被行进途中的障碍物挡住,磁场和电场能使粒子的行进方向偏转,由此证明,这股粒子流是带负电的粒子束。1897年,英国J.J.汤姆孙测定了粒子束的速度和荷质比是一个定值,不因阴极射线管所用的电极材料和管内所充气体的种类而变化,证明了粒子束是各种原子的共有组分,这种粒子束被命名为电子,即原子中含有电子。 众所周知,原子是中性的,汤姆孙认为,如果原子中有带负电的电子,那末,一定存在着等量的正电。汤姆孙的原子模型认为,原子是均匀带正电荷的,但里面均匀散布着很多带负电的电子。 1911年,英国E.卢瑟福发现卢瑟福模型,当一束a粒子穿过金箔时,大多数粒子仍然向前行进,并不改变方向。其中有一部分粒子改变了原来的途径,但偏转的角度不太大。只有极少数粒子偏转的角度很大,有个别粒子好像碰到了坚硬的不可穿透的东西,而被弹了回来。经过对上述实验的分析,卢瑟福得出结论,认为原子中存在着一个质量和正电荷都很集中、体积又很小的原子核。由此他提出的原子模型是:“在原子中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在核的周围沿着不同的轨道运动,就像行星环绕太阳运转一样。” 1913年,丹麦N.玻尔应用普朗克的量子概念提出了玻尔模型,其要点为:①电子只能在某些符合量子论导出的条件的轨道上运动,这些轨道称为稳定轨道或量子轨道。电子在量子轨道上运动,不放出能量,这时,电子处于稳定状态。②电子的轨道离原子核越远,原子的能量越大。原子在正常或稳定状态时,电子位于离核最近的轨道上,此时,原子的能量最低。当原子从外面获得能量时,电子可以过渡到一条较远的轨道上去,即这个电子已被激发到一个较高的能级上而处于激发状态。③只有在电子从较高的能级(即离核较远的轨道)跳到另一较低的能级(即离核较近的轨道)时,原子才会放出能量。如果放出的是辐射能,则它的频率v与始态能量E2和终态能量E1之差成正比: 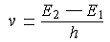
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条
|
|
| ©2008 dictall.com | |