2) conservation of orbital symmetry


轨道对称性守恒
3) principle of conservation of orbital symmetry


轨道对称守恒原理
1.
The course by which valent orbitals of reactants evolve into valent orbitals of product in a Di- els-Alder reaction has been discussed by using a three-orbital interaction method, and the evolutive result is in agreement with the principle of conservation of orbital symmetry.
根据三轨道作用法重点讨论了Diels-Alder反应中反应物轨道演变成产物轨道的过程,演变结果与轨道对称守恒原理的结果基本相同。
补充资料:分子轨道对称守恒原理
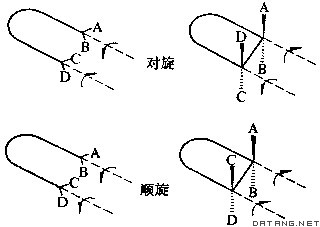
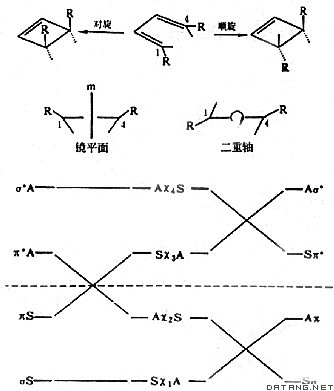
| 分子轨道对称守恒原理 conservation of molecular orbital symmetry,principle of 在协同反应中,反应循着保持分子轨道对称不变的方式进行。若在协同反应过程中自始至终存在某种对称要素,反应物和产物的分子轨道都可以按这种对称操作分类,则反应物与产物的分子轨道对称性相合时反应就易于发生,而不相合时就难于发生。单步骤的化学反应称为基元反应。协同反应是这样一种基元反应,在其反应过程中所涉及的化学键的变动是协同一致地进行的。一般说来,基元反应都是协同过程。 有机化学家R.B.伍德沃德首先从实验上总结了电环化 、环加成、σ迁移、嵌入等周环协同反应的规律性,这些反应的共同特点是在加热和光照的作用下得到不同的立体异构物。量子化学家R.霍夫曼从理论上对上述规律性进行分析。1965年两人共同提出了分子轨道对称守恒原理。这条原理可以用量子化学的能级相关理论,前线轨道理论或麦比乌斯结构理论加以阐明。 分子轨道对称守恒原理已推广到无机、催化、生化反应等许多重要领域,是微观化学反应动力学和量子化学应用的一个里程碑。 电环化反应 含有k个π电子的线型共轭体系,在其末端生成一个单键的反应及其逆反应,称为电环化反应。反应有对旋和顺旋两种情况,从而得到两种异构体( 图1 )。在对旋情况下,反应是以保持一个对称平面为特征;而顺旋过程始终具有一个二重对称轴。以丁二烯转变为环丁烯为例。丁二烯有4个π轨道:χ1、χ2、χ3、χ4 ,基态时χ和χ是占据的;环丁烯有一个占据的σ轨道和一个占据的π轨道,还有一个空的σ*轨道和一个空的π*轨道。按能级相关理论 ,在对旋和顺旋反应过程中保持轨道的对称性,按不相交规则,即相同对称性的轨道在反应过程中不相交,图 2 是这两个过程的能级相关图。在顺旋过程中,反应物和产物基态的分子轨道一一相连,因而在加热时丁二烯电环化反应只得到顺旋产物,与实验结果一致。而在对旋过程中,将有χ2与π*相连,在加热时基态难于反应,但若用光照射时就有电子激发到 χ3 轨道,则可关联到环丁烯的π轨道,反应容易进行 ,将得到对旋产物,与实验结果一致。由此,导出电环化反应的普遍规则:k个π电子体系的电环化热反应 ,当k=4q+2时是对旋的,当k=4q时则是顺旋的(q=0,1,2…);而当光照射时,分子达到第一激发态,上述规则正好反过来 。
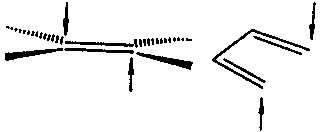
环加成反应 是指两个烯烃分子间的环化反应及其逆反应。环加成时有同面或异面两种过程。在同面过程中,生成键或断裂键位于进行反应的体系的同一面,例如在乙烯或顺丁二烯按箭头所示方向生成的键就是以同面方式进行的(图3 )。而在异面 过程中,生成键或断裂键处于反应体系的相反方面(图4)。同面过程和异面过程分别用 S 和A表示。以[2+2]反应为例,用分子轨道对称守恒原理分析反应的立体选择性。首先把4个参与反应的电子成对地放在环丁烷的2个非定域的前线轨道上,在[ 2s+2s]过程中,σ键断裂时,有 2 个电子按对称性守恒进入乙烯的成键轨道,另一对电子却进入另一个乙烯的反键轨道,因此[2s+2s ]反应是对称性禁阻的。然而,[2s+2A ]反应是对称性允许的。环加成反应的一般规则是:当 2 个反应分子中共轭碳原子数之和为4的整数倍时,热化学反应主要按同面 - 异面或异面-同面方式进行,光化学反应主要按同面-同面或异面-异面方式进行;当2个反应分子中共轭碳原子数之和为非4整数倍的偶数时 ,则热化学反应主要按同面-同面或异面-异面方式进行,光化学反应主要按同面-异面或异面-同面方式进行。
|
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条