1) electrochemical redox reaction


电化学氧化还原反应
2) microscopic electrochemical redox reaction


微电化学氧化还原反应
3) dynamics of oxidation-reduction


氧化还原反应动力学
1.
Studies on the dynamics of oxidation-reduction of Fe~(3+) with humic acids and fulvic acids;
采用邻二氮菲比色法研究了Fe3+与不同浓度的胡敏酸(HA)和富里酸(FA)的氧化还原反应动力学特征。
4) redox
[英][ri'dɔks] [美][rɪ'dɑks]


氧化还原反应
1.
The balancing of redox equation;


氧化还原反应方程式的配平
2.
The redox kinetics character of preparing non-pickling chrome tanning agent C-2000 was investigated by spectroscopic analysis.
结果表明:Cr(Ⅵ)的浓度高于SO2的浓度,反应有可能要在1min左右才能达到平衡;在温度很低的情况下,如5℃左右,氧化还原反应也能以较快的速度进行;酸度的增加能加快氧化还原反应的速率。
5) redox reaction


氧化还原反应
1.
The analogy between the acid-base reaction and redox reaction;


氧化还原反应与酸碱反应的类似性
2.
Judgement on complete extent in redox reaction;


氧化还原反应完全程度的判别
3.
The Research of New Method of Equilibration of Redox Reaction Equation;


氧化还原反应方程式配平的新方法探讨
6) oxidation-reduction reaction


氧化还原反应
1.
Through analysis and comparison,it is concluded that using FeSO_4 as reducing agent could broaden pH adjusting range of oxidation-reduction reaction and improve safety of operation;using the new high-efficiency coagulating reagent and adopting sludge recirculation technology could significantly reduce chemi.
通过比较和分析,最终提出了采用FeSO4作为还原剂处理含铬废水,氧化还原反应pH调节范围扩大,运行安全系数提高;利用新型高效混凝剂配合泥回流工艺,化学药品用量大幅下降,出水COD和SS含量显著减少。
2.
The method is based on the oxidation-reduction reaction between potassium iodide and nitrite.
建立了碘化钾与亚硝酸根氧化还原反应生成游离碘使异硫氰酸荧光素荧光猝灭测定痕量亚硝酸根的新方法。
3.
Applying the concept of electronic activity to discuss the oxidation-reduction reaction and cell potential is more convenient.
用电子活度表示电极上的电子有效浓度 ,讨论了电子活度的标准态和电子活度与电极电位的关系 ,指出运用电子活度的概念讨论氧化还原反应和电池电动势等更为方便 。
补充资料:氧化还原反应
| 氧化还原反应 oxidation-reduction reaction 在反应物之间有电子得失的反应。在这类反应中,一种原子失去电子,发生了氧化作用;另一种原子得到电子,发生了还原作用,两种作用合在一起,同时发生了氧化还原反应。例如氧化铜与氢气的反应: CuO+H2 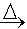 Cu+H2O Cu+H2O在反应过程中CuO中的Cu2+得到电子 ,H2的氢原子失去电子。在氧化还原反应中,得到电子而其本身发生还原反应(被还原)的物质称为氧化剂;失去电子而其本身发生氧化反应(被氧化)的物质称为还原剂。一种氧化剂被还原和一种还原剂被氧化的过程总是同时发生的,因此,氧化剂和还原剂总是相互依存在同一个反应中。 氧化还原的概念最早由法国A.-L.拉瓦锡提出,他把这一概念局限于:“凡是与氧气化合的反应称为氧化反应,氧气叫做氧化剂。凡被氧气氧化的物质称为还原剂。”后来,发现除了氧气以外,其他物质也能起氧化剂的作用,例如在金属钠与氯气的反应中: 2Na+Cl2  2NaCl2 2NaCl2氯气所起的也是氧化剂的作用。在现代原子结构理论建立以后,才开始用电子得失的概念对氧化还原反应作出本质的解释:“凡在氧化还原反应中得到电子的物质是氧化剂;失去电子的物质是还原剂。在反应中,氧化剂得到的电子总数必然等于还原剂失去的电子总数,使整个反应处于电荷平衡的状态。”例如在水溶液中Fe3+与I-反应生成Fe2+和I2,可分别写出还原反应和氧化反应: 还原反应:2Fe3++2e→2Fe2+ 氧化反应:2I-→I2+2e 这两个半反应的方程式合在一起就组成氧化还原方程式: 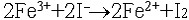 判断氧化还原反应中氧化剂得到电子和还原剂失去电子的难易程度可以用氧化数概念。氧化数又称氧化值,是单质或化合物中原子的表观电荷数,可用以下规定确定氧化数:①在单质中,元素原子的氧化数都等于零。②在离子化合物中,离子或原子团的正、负电荷数即它们的氧化数,如CuSO4中,Cu2+的氧化数为+2, 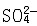 的氧化数为-2。③在共价化合物中,可按照元素电负性的大小,把共用电子对指定属于电负性较大的那个原子,即这个元素为氧化数的负值,其他元素为正值,然后由各原子的电荷数确定它们的氧化数。必须注意,确定和应用氧化数必须结合具体的氧化还原反应。 的氧化数为-2。③在共价化合物中,可按照元素电负性的大小,把共用电子对指定属于电负性较大的那个原子,即这个元素为氧化数的负值,其他元素为正值,然后由各原子的电荷数确定它们的氧化数。必须注意,确定和应用氧化数必须结合具体的氧化还原反应。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条