1) hydrogen compler


氢配位键
1.
This article discuses the nature of the funtions of hydrogen band, hydrogen bridge band and hydrogen compler respectivly and their internal relationships.
讨论了氢桥键、氢键、氢配位键的共同特征,指出了氢键、氢桥键、氢配位键都是氢键,氢桥是氢键作用过程的基本形式,氢键、氢桥键、氢配位键是桥氢受两端基团作用力不同而引起的不同的氢键作用结果。
2) coordination bond


配位键
1.
It was found that retarding admixtures belonged to the category of coordination compounds,its chemical nature was attributed to coordination bond.
Werner)配位学说和立体化学有关理论,分析研究了无机、有机缓凝外加剂的分子结构和特征,发现缓凝外加剂都是配位化合物,化学本质是配位键。
2.
In this thesis, Gemini-type surfactants through coordination bond by linking two conventional surfactants were studied, which took a single metal ion as “spacer”.
本课题是研究单个金属离子作为联接基,利用金属配位键构筑Gemini 型表面活性剂。
3) Coordinate bond


配位键
1.
The results showed that the surface adsorption ability of GaP nanocrystal is much higher than that of InP nanocrystal,because there is rather strong coordinate bond formed between Ga .
这是因为Ga能够与氮分子形成较强的配位键 ,对氮分子的吸附作用增
4) Coordinated hydrogenation


配位加氢
5) d-π coordination bond


d-π配位键
6) coordinative bonds


金属配位键
1.
The principle of molecular imprinting technique and designs selective sites in templated poly-mers by taking advantage of coordinative bonds as advance driving force were introduced.
介绍了分子印迹技术的原理和金属配位键独特的优点,并着重介绍金属配位化合物在模板聚合物设计中的应用及研究现状。
补充资料:配位键
| 配位键 coordination bond 一种共价键。成键的两原子间共享的两个电子不是由两原子各提供一个,而是来自一个原子。例如氨和三氟化硼可以形成配位化合物: 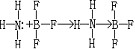 式中→表示配位键。在N和B之间的一对电子来自N原子上的孤对电子。 式中→表示配位键。在N和B之间的一对电子来自N原子上的孤对电子。配位键是极性键,电子总是偏向一方,根据极性的强弱,或接近离子键,或接近极性共价键。在一些配合物中,除配体向受体提供电子形成普通配位键外,受体的电子也向配体转移形成反馈配键 。例如Ni(CO)4中CO中碳上的孤对电子向镍原子配位形成σ配位键 ,镍原子的d电子则反过来流向CO的空π*反键轨道,形成四电子三中心d-pπ键,就是反馈配键。非金属配位化合物中也可能存在这种键。配位键可用以下3种理论来解释: ①价键理论。认为配体上的电子进入中心原子的杂化轨道。例如钴(Ⅲ)的配合物。〔CoF6〕3-中F的孤对电子进入Co3+的sp3d2杂化轨道,这种配合物称为外轨配合物或高自旋配合物,有4个未成对电子,因而是顺磁性的。〔Co(NH3)-6〕3+中NH3的孤对电子进入Co3+的d2sp3杂化轨道 ,这种配合物称为内轨配合物或低自旋配合物,由于所有电子都已成对,因而没有顺磁性而为抗磁性。 ②晶体场理论。将配体看作点电荷或偶极子,同时考虑配体产生的静电场对中心原子的原子轨道能级的影响。例如,把中心原子引入位于正八面体6个顶角上的6个配体中,原来五重简并的d轨道就分裂成一组二重简并的eg(  -y2、dz2)轨道和一组三重简并的t2g(dxy、dxz、dyz)轨道 。eg和t2g轨道的能量差 ,称为分离能Δ0,Δ0≡10Dq,Dq称为场强参量。在上述钴(Ⅲ)配合物中,6个F-产生的场不强,Δ0较小,d电子按照洪德规则排布,有四个未成对电子,因而〔CoF6〕3-为弱场配合物或高自旋配合物 。6个NH3产生的场较强,Δ0较大,d电子按照能量最低原则和泡利原理排布,没有未成对电子 ,因而〔Co(NH3)6〕3+为强场配合物或低自旋配合物。 -y2、dz2)轨道和一组三重简并的t2g(dxy、dxz、dyz)轨道 。eg和t2g轨道的能量差 ,称为分离能Δ0,Δ0≡10Dq,Dq称为场强参量。在上述钴(Ⅲ)配合物中,6个F-产生的场不强,Δ0较小,d电子按照洪德规则排布,有四个未成对电子,因而〔CoF6〕3-为弱场配合物或高自旋配合物 。6个NH3产生的场较强,Δ0较大,d电子按照能量最低原则和泡利原理排布,没有未成对电子 ,因而〔Co(NH3)6〕3+为强场配合物或低自旋配合物。③分子轨道理论 。假定电子是在分子轨道中运动,应用群论或根据成键的基本原则就可得出分子轨道能级图。再把电子从能量最低的分子轨道开始按照泡利原理逐一填入,即得分子的电子组态。分子轨道分为成键轨道和反键轨道。分子的键合程度取决于分子中成键电子数与反键电子数之差。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条