1) dsp 2 hybrid orbits


dsp2杂化轨道
2) Hybrid orbital


杂化轨道
1.
Equivalent and nonequivalent of hybrid orbitals;


杂化轨道的等性与不等性
2.
On the basis of hybrid orbital theory and valence shell electron pair repulsion (VSEPR) theory that anticipate and judge the configuration of covalent polyatomic molecule or iron(not including complexes),a simple and convenient method to calculate the type of the central atomic hybrid orbital directly is deduced by the valence shell electron pairs.
根据用杂化轨道理论和价层电子对互斥理论预测和判断共价多原子分子或离子 (不包括配合物 )空间构型的原理 ,导出了一种用价层电子对数直接预测中心原子轨道杂化类型的简便方
3.
In this paper,the nip angle formula between hybrid orbitals is introduced.


介绍了杂化轨道间夹角公式。
3) orbital hybridization


轨道杂化
1.
In this paper, we discuss the reason of the negative resistance phenomenon(NRP) existing in a MIM(metal insulator metal)light emission tunnel junction s I V character by using orbital hybridization theory for the first time.
首次从轨道杂化的角度探讨了 MIM隧道结负阻特性的成因 ,结合化学上的计算 ,并与实际测量结果进行对比分析 ,提出了 MIM隧道结负阻特性的理论解
4) hybridization
[英][,haibridai'zeiʃən] [美][,haɪbrɪdə'zeʃən]


轨道杂化
1.
An anomalously large up\|shift of 9?cm -1 between 20?K and room temperature for the pinch Ag(2) mode suggests the existence of hybridization between the C 60 molecules and the intercalants.
径向Ag(2 )模的频率在 2 0K到室温之间有一个反常大的向高频漂移 (9cm-1) ,这表明在C60 分子和掺杂离子之间存在着轨道杂化 。
2.
Also,more emphysises have been placed on the effects of the sp-d hybridization of Co atom on the stabilities and magnetism.
N≥8时,Co原子陷入主团簇内部,体系的对称性降低,稳定性增强;轨道杂化增强了体系的稳定性,但减小了双重态和三重态体系中Co原子的磁矩;N=3,8,10是团簇CoAlN(N=2-11)的幻数。
5) hybridized orbital


杂化轨道
1.
Based on the hybridized orbital theory and electron partnership theory,a method for predicting molecular geometries is proposed Using it ,the geometries of molecules with AB_n can be predicted simply and correctly.
本文研究的预测分子空间构型的方法是以杂化轨道理论为基础 ,根据电子配对原理 ,简明、准确地预测ABn 型分子的空间构型。
6) Electron density redistribution


轨道再杂化
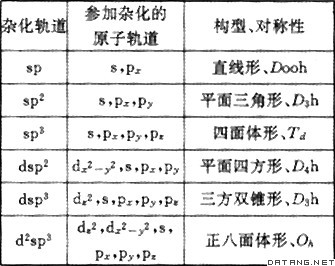
补充资料:杂化轨道
| 杂化轨道 hybrid orbital 一个原子中的几个原子轨道经过再分配而组成的互相等同的轨道。原子在化合成分子的过程中,根据原子的成键要求,在周围原子影响下,将原有的原子轨道进一步线性组合成新的原子轨道。这种在一个原子中不同原子轨道的线性组合,称为原子轨道的杂化。杂化后的原子轨道称为杂化轨道。杂化时,轨道的数目不变,轨道在空间的分布方向和分布情况发生改变。组合所得的杂化轨道一般均和其他原子形成较强的σ键或安排孤对电子,而不会以空的杂化轨道的形式存在。在某个原子的几个杂化轨道中,参与杂化的s、p、d等成分相等,称为等性杂化轨道;若不相等,称为不等性杂化轨道。一些常见的杂化轨道如下表所示:
杂化轨道具有和s,p等原子轨道相同的性质,必须满足正交,归一性。例如,由s和p轨道组成杂化轨道yi=ais+bip,由归一性可得∫yi*yijdt=1,a2+b2=1由正交性可得∫yi*yjdt=0(i 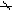 j时)。根据这一性质,考虑杂化轨道的空间分布及未杂化前原子轨道的取向,就能写出各个杂化轨道中原子轨道的组合系数。例如,由s,px ,py组成的平面三角形的sp2杂化轨道y1,y2,y3,当y1极大值方向和x轴平行,由等性杂化概念可知每一轨道s成分占1/3,组合系数为1/ j时)。根据这一性质,考虑杂化轨道的空间分布及未杂化前原子轨道的取向,就能写出各个杂化轨道中原子轨道的组合系数。例如,由s,px ,py组成的平面三角形的sp2杂化轨道y1,y2,y3,当y1极大值方向和x轴平行,由等性杂化概念可知每一轨道s成分占1/3,组合系数为1/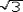 ,其余2/3成分全由p轨道组成,因y1与x轴平行,与y轴垂直,py没有贡献,全部为px,所以得到y1= ,其余2/3成分全由p轨道组成,因y1与x轴平行,与y轴垂直,py没有贡献,全部为px,所以得到y1=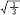 s+ s+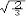 px;同理可得y2= px;同理可得y2=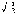 s- s-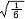 px+ px+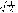 py;y3= py;y3=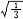 s- s-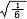 px- px-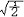 py。并可验证 y1,y2、y3 ,满足正交归一性。根据杂化轨道的正交、归一条件,推求两个等性杂化轨道的最大值之间的夹角θ,可按下式计算:a+βcosθ+ py。并可验证 y1,y2、y3 ,满足正交归一性。根据杂化轨道的正交、归一条件,推求两个等性杂化轨道的最大值之间的夹角θ,可按下式计算:a+βcosθ+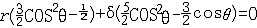 ,式中a,β,γ,δ分别为杂化轨道中s,p,d,f,轨道所占的百分数。两个不等性杂化轨道Ψi和Ψj的最大值之间的夹角θij 可按下式计算: ,式中a,β,γ,δ分别为杂化轨道中s,p,d,f,轨道所占的百分数。两个不等性杂化轨道Ψi和Ψj的最大值之间的夹角θij 可按下式计算: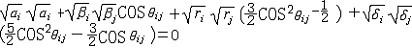 由不等性杂化轨道形成的分子,其准确的几何构型需要通过实验测定,而不能预言其键角的准确值。 由不等性杂化轨道形成的分子,其准确的几何构型需要通过实验测定,而不能预言其键角的准确值。
|
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条