1) Chemical Equilibrium Thermodynamics


化学平衡热力学
2) chemical thermal equilibrium


化学热力学平衡
1.
The chemical thermal equilibrium was used to investigate the transformation law of elemental mercury(Hg0),which was oxidized into divalent mercury(Hg2+) at different flue gas temperature,and the results were compared with the experimental results.
通过化学热力学平衡模拟,研究了在不同烟气温度下汞从元素态汞转化为二价汞的规律,并与小型实验结果进行了比较。
3) thermodynamical equilibrium analysis


化学热力学平衡计算
4) thermodynamic equilibrium


热力学平衡
1.
Calculation of thermodynamic equilibrium for reactions of plutonium with air;


氢化钚与空气反应的热力学平衡计算
2.
The calculation results of the model show that: (1)from the flow rate and composition of the exhaust gas and the carbon content of the raw material, the carbon content of steel bath can be dynamically determined; (2)with the aid of thermodynamic equilibrium analysis, the dynamic variation of temperature and oxygen content of the stee.
本模型的计算结果表明:(1)通过烟气流量、成分及原料中初始碳含量可动态地确定熔池中的碳含量;(2)以动态确定的碳含量为基础,经过热力学平衡分析,可确定熔池内温度及氧含量的动态变化。
3.
In order to find the temperature range and initial reactant ratio for the maximum yield of acetylene, chemical thermodynamic equilibrium of heterogeneous multi-component C-H system was studied.
计算表明:把C-H体系视为单相体系是不合理的,只有在多相体系下的计算结果才是真正意义上的热力学平衡组成,两种体系在生成乙炔的最佳温度范围和平衡组成两方面都有较大的差别。
6) thermo-chemical equilibrium


热化学平衡
1.
By analyzing the thermo-chemical reaction mechanism of the biomass gasification process,the thermo-chemical equilibrium model is established based on mass balance,heat balance,gasification reaction equilibrium.
生物质气化是生物质能利用的有效方式之一,通过分析气化过程热化学反应机理,基于气化过程的物料平衡、热量平衡和热化学反应平衡关系,建立了一种生物质气化过程的热化学平衡模型。
补充资料:化学平衡
| 化学平衡 chemical equilibrium 在一定条件下系统内能发生化学反应的各物质的组成将不随时间而改变的现象。它是一个动态平衡,从微观上看,处于化学平衡的系统内反应仍在进行,但正、逆两个方向的反应速率相等,因而系统的组成不变。 平衡条件 化学反应的通式可表示为0=ΣBvB,式中B为反应方程式中的任一物质,v则是反应方程式中物质B的化学计量数,对反应物vB取负值,产物的vB取正值。如果反应系统为一封闭系统,且反应在无非体积功的条件下进行,则当ΣBvBμB<0时,反应可自动正向进行;当ΣBvBμB>0时,反应反向自动进行;当ΣBvBμB=0时,系统达到化学平衡状态。上述式中μB为反应系统在任一给定状态下物质B的化学势。定义 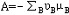 ,A称为化学反应的亲和势。化学平衡的条件即为A=0。 ,A称为化学反应的亲和势。化学平衡的条件即为A=0。平衡常数 当系统在一定条件下达到化学平衡时,产物和反应物的数量之间将保持一定的关系,可用平衡常数来描述这种关系。标准平衡常数 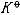 定义为: 定义为: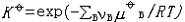 式中 式中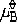 为物质B的标准化学势;R为摩尔气体常数;T为系统的热力学温度。 为物质B的标准化学势;R为摩尔气体常数;T为系统的热力学温度。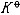 是无量纲的量。对一个指定的反应方程式,其 是无量纲的量。对一个指定的反应方程式,其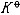 值仅仅取决于反应系统的温度和标准态的选择。如果将反应写作不同的计量方程式,则因vB的不同 值仅仅取决于反应系统的温度和标准态的选择。如果将反应写作不同的计量方程式,则因vB的不同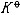 , ,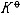 也不同。 也不同。在不同聚集态物质的反应中,可以根据物质B的化学势表达式,写出 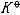 与系统平衡组成之间的关系式。例如,如果反应系统中的物质均为理想气体,则: 与系统平衡组成之间的关系式。例如,如果反应系统中的物质均为理想气体,则: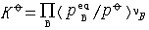 式中 式中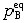 为反应达平衡时,气体B的分压, 为反应达平衡时,气体B的分压,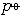 为标准压力。 为标准压力。 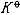 与温度的关系为: 与温度的关系为: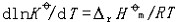 式中 式中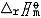 为反应的标准摩尔焓变。 为反应的标准摩尔焓变。一个化学反应的 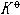 是该反应进行限度的标志。 是该反应进行限度的标志。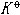 的值可由反应系统的平衡组成计算,也可根据某些已知的热力学数据计算。 的值可由反应系统的平衡组成计算,也可根据某些已知的热力学数据计算。已经处于化学平衡的系统,如果环境条件发生变化,则系统的平衡状态被破坏,系统的组成发生变化,系统在新的条件下达到一个新的平衡状态,这种情况称为平衡的移动。温度、压力、惰性气体等因素的改变都可能引起平衡的移动。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条