1) Arrhenius theory of dissociation


阿伦纽斯电离理论
3) Arrhenius theory


阿伦尼乌斯理论
4) Arrhenius ionization theory


阿累尼乌斯电离理论
5) Arrhenius curve


阿伦纽斯曲线
6) Fellenius method


费伦纽斯法
1.
Base on the limit equilibrium theory, we choose the Bishop method, and refer to the Fellenius method, to make analysis and evaluation to the stability of Gushan Iiron Deposit s eastern dike which has been reinforced.
基于极限平衡理论,采用以简化毕肖普法为主,费伦纽斯法作为参照的分析方法,对姑山铁矿采矿场东帮及青山河河堤防渗加固后的稳定性进行了分析评价,根据不同的爆破震动大小,得出背水面和迎水面多个安全系数值,取得了较为可靠的分析结果。
补充资料:阿伦尼乌斯电离理论
| 阿伦尼乌斯电离理论 Arrhenius ionization theory 瑞典化学家S.A.阿伦尼乌斯提出的电解质在溶液中自动离解成正、负离子的理论。 简史 关于电解质(酸、碱、盐)的水溶液为什么会导电的问题,从19世纪初就为科学界所关注。1834年,英国M.法拉第在论文《关于电的实验研究》中提出,在电解时溶液中的电流是由带电荷的分解产物传输的,他把电解前未分解的物质叫做电解质,传输电流的分解产物叫做离子,带正电并向阴极移动的离子称为阳离子;带负电并向阳极移动的离子称为阴离子。法拉第认为离子是在电流的作用下产生的。当时的科学界把这种观点视为金科玉律。阿伦尼乌斯在研究高度稀释的电解质水溶液的电导时,发现电解质分子会自动离解,他先后于1883年和1887年发表了两篇论文——《电解质的导电性研究》和《关于溶质在水中的离解》,内容为酸、碱、盐在水溶液中自动地部分离解为带不同电荷的离子,而不需要借助电流的作用产生离子。在无限稀释的溶液中,电解质接近百分之百离解。不同电解质在水溶液中的离解程度是不一样的,离解程度可用电离度表示,它是溶液中已经电离的电解质分子数占原来总分子数(包括已经电离和尚未电离的)的百分数。阿伦尼乌斯电离理论发表后,遭到大多数科学家的反对,经过J.H.范托夫和F.W.奥斯特瓦尔德的支持,才获得公认。 应用 阿伦尼乌斯认为,离子对于稀溶液的依数性(电解质溶液的蒸气压下降、凝固点降低、沸点升高)起着同未离解分子一样的作用,它们的凝固点降低等依数性应该是同浓度非电解溶液的倍数,这个倍数就是范托夫系数。 在相同情况下(指溶液浓度和其他外界条件),下列在水溶液中发生的中和反应所放出的热量都相同: HCl+NaOH  NaCl+H2O NaCl+H2O HCl+KOH  KCl+H2O KCl+H2O HNO3+NaOH  NaNO3+H2O根据电离理论,强酸在稀溶液中几乎完全电离为氢离子和酸根离子;强碱在稀溶液中也几乎完全电离为氢氧根离子和金属离子,强酸与强碱的中和反应实质上是氢离子与氢氧根离子之间的反应: NaNO3+H2O根据电离理论,强酸在稀溶液中几乎完全电离为氢离子和酸根离子;强碱在稀溶液中也几乎完全电离为氢氧根离子和金属离子,强酸与强碱的中和反应实质上是氢离子与氢氧根离子之间的反应:H++OH-  H2O酸根离子和金属离子都留在溶液中,并未发生变化,因此上述各反应放出的热量都是相同的。 H2O酸根离子和金属离子都留在溶液中,并未发生变化,因此上述各反应放出的热量都是相同的。不同盐类(强电解质)的溶液混合后,假如没有气体产生或沉淀析出,则反应既不放热,又不吸热,例如氯化钠溶液与硝酸钾溶液混合后,生成物氯化钾和硝酸钠也都是可溶性盐,它们在稀溶液中都离解为离子,实质上此反应是四种离子(Na+、Cl-、K+、 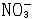 )混合在一起,并没有发生其他变化。 )混合在一起,并没有发生其他变化。溶液的颜色往往与固体的颜色不同,例如CuCl2固体是棕黄色的,CuBr2固体是黑色的,CuSO4·5H2O固体是蓝色的。将这三种固体配成稀溶液,则溶液全是蓝色的。这一现象可以用电离理论解释,由于这三种铜盐溶于水,全离解产生Cu2+,而离解出来的阴离子Cl-、Br-、 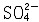 都是无色的,所以溶液所显的蓝色就是Cu2+的颜色。 都是无色的,所以溶液所显的蓝色就是Cu2+的颜色。氯化物可以用硝酸银来检验,不论是氯化钠、氯化钾、氯化钙或其他氯化物溶液,只要加入硝酸银溶液,都会产生白色的氯化银沉淀,和它是钠盐、钾盐、钙盐无关,这又一次证明了在稀溶液中这些盐类都是以离子的形式存在,这种检验反应实质上是氯离子与银离子之间的反应: Cl-+Ag+  AgCl↓由此可见,电离理论是盐类定性分析方法的理论基础。 AgCl↓由此可见,电离理论是盐类定性分析方法的理论基础。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条