1) baryta
[英][bə'raitə] [美][bə'raɪtə]


鋇氧
2) baryta white


鋇白
3) baryta green


鋇綠
4) hyalophane
['haiələu,fein]


鋇冰长石
5) celsianite


鋇长石
6) Gumbelina


鋇爾蟲
补充资料:氧
| 氧 oxygen 一种化学元素 。化学符号O ,原子序数8 ,原子量15.9994,属周期系ⅥA族。 氧的发现 1774年英国J.普里斯特利用一个大凸透镜将太阳光聚焦后加热氧化汞,制得纯氧,并发现它助燃和帮助呼吸,称之为“脱燃素空气”。瑞典C.W.舍勒用加热氧化汞和其他含氧酸盐制得氧气虽然比普里斯特利还要早一年,但他的论文《关于空气与火的化学论文》直到1777年才发表,但他们二人确属各自独立制得氧。1774年,普里斯特利访问法国,把制氧方法告诉A.-L.拉瓦锡,后者于1775年重复这个实验,把空气中能够帮助呼吸和助燃的气体称为oxygene,这个字来源于希腊文oxygenēs,含义是“酸的形成者”。因此,后世把这三位学者都确认为氧气的发现者。 氧的存在 氧有三种稳定同位素,即氧16、氧17和氧18,其中氧16含量占99.759% 。氧在地壳中的含量为48.6%,居首位,氧在地球上分布极广,大气中的氧占23%,海洋和江河湖泊中到处都是氧的化合物水,氧在水中占88.8%。地球上还存在着许多含氧酸盐,如土壤中所含的铝硅酸盐,还有硅酸盐、氧化物、碳酸盐的矿物。大气中的氧不断地用于动物的新陈代谢,人体中氧占65%,植物的光合作用能把二氧化碳转变为氧气,使氧得以不断地循环。虽然地球上到处是氧,但氧主要是从空气中提取的,有取之不尽的资源。 物理化学性质 氧 是无色、无臭、无味的气体,熔点-218.4℃ ,沸点-182.962℃ ,气体密度1.429克/厘米3 ,液态氧是淡蓝色的 。氧是化学性质活泼的元素 ,除了惰性气体,卤素中的氯、溴、碘以及一些不活泼的金属(如金、铂)之外 ,绝大多数非金属和金属都能直接与氧化合,但氧可以通过间接的方法与惰性气体氙生成氧化物: XeF6 + 3H2O  XeO3 + 6HF XeO3 + 6HF同样,氯的氧化物也可以通过间接的方法制得: 2Cl2+2HgO  HgO·HgCl2+Cl2O HgO·HgCl2+Cl2O在常温下,氧还可以将其他化合物氧化: 2NO+O2  2NO2 2NO2氧可以将葡萄糖氧化,这一作用是构成生物体呼吸作用的主要反应: C6H12O6+6O2  6CO2+6H2O 6CO2+6H2O氧的氧化态为 -2、-1、+2 。氧的氧化性仅次于氟,因此,氧和氟发生反应时,表现为+2价,形成氟化氧(F2O)。氧与金属元素形成的二元化合物有氧化物、过氧化物、超氧化物。氧分子可以失去一个电子,生成二氧基正离子( 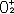 ),形成O2PtF6等化合物。 ),形成O2PtF6等化合物。氧气的实验室制法有:①氯酸钾的热分解:  ②电解水: ②电解水: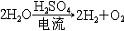 ③氧化物热分解: 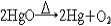 ④以二氧化锰做催化剂,使过氧化氢分解: 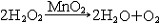 在宇宙飞船中 ,可利用宇航员呼出的二氧化碳气体与超氧化钾作用,产生氧气,供宇航员呼吸用。 在宇宙飞船中 ,可利用宇航员呼出的二氧化碳气体与超氧化钾作用,产生氧气,供宇航员呼吸用。生产和应用 大规模生产氧气的方法是分馏液态空气,首先将空气压缩,待其膨氧胀后又冷冻为液态空气,由于稀有气体和氮气的沸点都比氧气低,经过分馏,剩下的便是液氧,可贮存在高压钢瓶中。所有的氧化反应和燃烧过程都需要氧,例如炼钢时除硫、磷等杂质,氧和乙炔混合气燃烧时温度高达3500℃,用于钢铁的焊接和切割。玻璃制造、水泥生产、矿物焙烧、烃类加工都需要氧。液氧还用作火箭燃料,它比其他燃料更便宜。在低氧或缺氧的环境中工作的人,如潜水员、宇航员,氧更是维持生命所不可缺少的。但氧的活性状态如 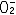 、OH以及H2O2等对生物的组织有严重的损坏作用,紫外线对皮肤和眼的损害多与此种作用有关。 、OH以及H2O2等对生物的组织有严重的损坏作用,紫外线对皮肤和眼的损害多与此种作用有关。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条