1) sociological theory and meta-theory


社会学理论和元理论
2) sociological theory


社会学理论
1.
The formation of sociological theory is the basic symbol of the sociology as an independent discipline.
“社会学理论”的形成是社会学学科独立的基本标志。
2.
So we describe the three characters of Pierre Bourdieu′s sociological theory.


由此可以概括出其社会学理论的三个特征:一、思想渊源的广泛性;二、超越二元对立的实践理论;三、“反思性社会学”。
3) sociology theory


社会学理论
1.
Sociology theory always try to clearly describe and interpret both the society action and the complex life world coming from it,and grasp the truth on the base of familiarization.
社会学理论总是试图清晰地描述并解释社会行动及由此产生的复杂的生活世界 ,在熟知的基础上达到真知。
4) theoretical sociology


理论社会学
1.
Concern with the training and research of theoretical sociology will help promote the construction of local sociological theory.
当前经验研究的“过密化”现象是由理论意识和理论指导贫乏所致 ,理论社会学是把历史、理论和方法统一起来的基础学科 ,关注理论社会学的训练和研究 ,对本土社会学理论发展将起到促进作用。
5) harmonious social theory


和谐社会理论
1.
Analysis on western Marxist theorists harmonious social theory;


试析西方马克思主义理论家的和谐社会理论
6) Harmonious Society Theory


和谐社会理论
1.
On Marxism Humanistic Basis of Harmonious Society Theory;


论和谐社会理论的马克思主义人学根据
2.
Paraconsistent logic is the underlying logic of constructing the harmonious society theory.
构建和谐社会理论的根本目标是要消除现实社会中存在的各种矛盾和不和谐现象。
补充资料:元反应速率理论
 yuanfanying sul
yuanfanying sul lilun
lilun 元反应速率理论
元反应速率理论N-elementary reactionrate theory
在一定的模型假定下应用统计热力学、经典力学和量子力学等来研究元反应速率的理论,它包括简单碰撞理论、量子力学的碰撞理论和过渡态理论。知道了一个复杂反应中各个元反应的速率,就能知道该复杂反应的速率,从而把研究化学反应速率的问题归结为研究各元反应速率的问题。
简单碰撞理论 两个分子必须碰到一起(称为两个分子发生了碰撞),然后才能起化学反应。一个分子在一秒钟内同其他分子碰撞的次数称为碰撞频率。简单碰撞理论认为,相碰分子的总动能必须大于某个值才会发生化学反应。分子碰撞而能发生化学反应的最小动能称为临界能

 ,
,
 随碰撞分子而异
随碰撞分子而异 [kg2]
[kg2] 一立方厘米体积中,两个分子在一秒钟内相碰撞的次数称为碰撞速率。能够发生化学反应的碰撞称为有效碰撞
一立方厘米体积中,两个分子在一秒钟内相碰撞的次数称为碰撞速率。能够发生化学反应的碰撞称为有效碰撞 分子碰撞理论认为,化学反应的速率等于有效碰撞速率。
分子碰撞理论认为,化学反应的速率等于有效碰撞速率。假设分子为刚球,分子A的半径为

 ,分子B的半径为
,分子B的半径为
 ,每立方厘米内有
,每立方厘米内有
 个A分子和
个A分子和
 个B分子,分子A对分子B的平均相对速度为
个B分子,分子A对分子B的平均相对速度为 ,则A分子同B分子的碰撞速率
,则A分子同B分子的碰撞速率

 为:
为:[749-04]
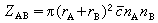 此式是出于如下考虑得到的,即以[kg2]
此式是出于如下考虑得到的,即以[kg2]

 +
+
 为半径的圆面在一秒钟内运动所扫过的体积为
为半径的圆面在一秒钟内运动所扫过的体积为 (
(
 +
+
 )
)
 ,在此体积内分子A的数目为
,在此体积内分子A的数目为  (
(
 +
+
 )
)


 ,它们都能分别与该体积中的一个分子B碰撞
,它们都能分别与该体积中的一个分子B碰撞
 (
(
 +
+
 )
)


 为分子B的碰撞频率,将它乘以分子[kg1]
为分子B的碰撞频率,将它乘以分子[kg1] B 的密度
B 的密度
 就得到碰撞速率
就得到碰撞速率

 。相碰撞分子的总动能有大有小,总动能
。相碰撞分子的总动能有大有小,总动能 超过
超过
 的碰撞,才能起化学反应,这相当于以下假定:
的碰撞,才能起化学反应,这相当于以下假定:[749-02]
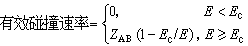 根据玻耳兹曼分布率,可得平均有效碰撞速率为:
根据玻耳兹曼分布率,可得平均有效碰撞速率为:(


 )[xb-eff]
)[xb-eff]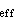 =
=

 exp(-
exp(-
 /
/
 )
)如果分子A和分子B是同种分子,则如上算得的碰撞速率应除以2,因为对于同种分子,上述计数实际重复了两次。
分子不是球型的,更不是刚球,所以两个分子碰撞是否有效,还须看碰撞的方位如何。例如,氢原子同氟化氢分子的碰撞,可分为两种方位:
H+HF─→H
 +F
+FH+FH─→HF+H对于生成氢分子来说,只有前一种碰撞有效,所以真正的平均有效碰撞速率是上述平均有效碰撞速率乘以一个小于1的因子
 :
:(


 )[xb-eff]
)[xb-eff]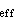 =
=


 exp(-
exp(-
 /
/
 )式中
)式中 为方位因子。
为方位因子。反应速率常数
 等于分子浓度为1单位时的有效碰撞速率:
等于分子浓度为1单位时的有效碰撞速率:[749-05]
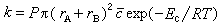 因为[749-03]
因为[749-03]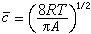 ,它与绝对温度
,它与绝对温度 有关,而S.A.阿伦尼乌斯提出的指数定律(见活化能)的指前因子
有关,而S.A.阿伦尼乌斯提出的指数定律(见活化能)的指前因子 与温度无关,所以
与温度无关,所以
 不等于活化能。
不等于活化能。量子力学的碰撞理论 分子起化学反应,是分子中的电子和原子核相互作用和运动的结果,例如以下双分子元反应:
A+B─→C+D分子A和分子B由彼此相距很远,运动至相距很近,以至碰撞,从而分子A中的电子同分子B中的电子和原子核相互作用,分子相距越近,相互作用越强。这种相互作用改变电子和原子核的结合对象,使原来的分子分解,生成新分子。
电子的质量比原子核的质量小很多,运动比原子核快得多。电子运动一周,原子核基本未动。因此,原子核是在电子的平均力作用下运动的,该力决定着原子核运动所受的势能,它是原子核间距的函数,称为势能函数。如果势能函数只是两个独立核间距的函数,则以两个核间距为纵横坐标对势能函数作图,得到一个真正的曲面,称为势能面。如果势能函数是三个以上独立核间距的函数,将势能函数对独立核间距作图,则得到广义的曲面,称为超势能面。
当原子与双原子分子起反应,且三个原子在一条直线上运动时,势能函数只是两个独立变量的函数,例如共线反应(图1[H+H
 共线反应示意图]
共线反应示意图]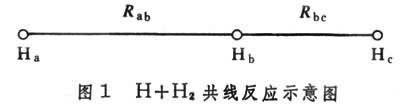 共线反应示意图" class=image>):
共线反应示意图" class=image>):H
 +H
+H -H
-H ─→H
─→H -H
-H +H
+H 势能函数是两个独立变量核间距
势能函数是两个独立变量核间距 [xb-ab]
[xb-ab]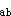 和
和 [xb-bc]
[xb-bc]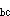 的函数。
的函数。
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条