1) redox potentials


氧还电势
1.
The results showedthat the redox potentials of all the complexes were exceptionally high compared with that of the Cu(Ⅱ)/Cu(Ⅰ) couple in aqueous solution, which are close to those for the blue copper proteins.
合成了配合物Cu(ibtmb)2X2和Cu(ibtmb)X2[X=Cl或Br,ibtmb=2-(异丁硫甲基)苯并咪唑],并用元素分析、摩尔电导、IR、UV/Vis谱以及电化学方法进行了表征,结果表明:与水溶液中相比,所研究配合物均具有异常高的氧还电势,类似于对蓝铜蛋白所获得的结果。
2) oxidation reduction electro-dynamic potential


氧化还原电动势
3) oxidation-reduction electrodynamic potential


氧化-还原电动势
5) oxidation-reduction potential (rH)


氧化还原电势 rH
6) rH


氧化还原电势;氧化还原电位势
补充资料:氧化还原电势
| 氧化还原电势 oxidation-reduction potential 衡量电极反应趋势的参数和判断氧化还原反应能否进行的依据。又称电极电势。当一个金属电极浸在该金属的一种盐溶液中时,金属中的原子有离开晶格,转变为金属正离子进入溶液的倾向;溶液中的金属离子也有在金属电极的表面还原为原子而沉积的趋势。这样,在电极表面上因聚积电子而带负电,靠近电极表面的溶液中可能聚积着金属离子而带正电,因而在电极和溶液之间存在着一定的电势差。现在采用的氧化还原电势都是相对值,将1×105帕的氢气所饱和的铂片与浓度为1摩尔/升的氢离子溶液之间的电势差规定为零,即规定下列还原反应的平衡电势等于零: 2 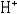 +2e +2e H2 H2然后将其他物质与相应的溶液所构成的电极直接或间接地与标准氢电极组成化学电池,进行测定对比,求得它们的电势 。当在1×105帕压力下和溶液中Mn+离子的浓度为1摩尔/升时,电池的电势便是标准电势。
一种物质的还原电势越大,表明它越容易还原,即该物质越容易从其他物质获取电子,并将其他物质氧化,本身是越强的氧化剂。表中最下面所列的一些半反应中,左侧都是强氧化剂。最上面所列的那些半反应中,右侧的物质都是强还原剂。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条
