1) nickel propylene complex


Ni-丙烯过渡态配位化合物
3) hexa-coordinate


六配位过渡态
1.
The mechanism was proposed that due to the participation of the imidazole group, the phosphorus could be transformed into a hexa-coordinate transition state which was much favorable for the group exchange reaction.
由此提出了以下机理:由于眯唑环的参与,磷可以形成六配位过渡态,从而加快了反应速度。
4) carbine complexes


碳烯配位化合物
5) transition-metal compound


过渡态金属化合物
6) π-allyl metal complexes


π-烯丙基金属配位化合物(π-allyl metal coordination compounds)
补充资料:配位化合物
| 配位化合物 coordination compound 一类由中心原子(包括原子或离子)和围绕它的配位体(包括离子或分子)通过配位键相结合的化合物 。简称配合物。 组成 配合物由中心原子、配位体和外界组成 ,例如硫酸四氨合铜(Ⅱ)分子式为 〔Cu(NH3)4〕SO4,其中Cu2+是中心原子,NH3是配位体, 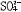 是外界。中心原子可以是带电的离子,如〔Cu(NH3)4〕SO4中的Cu2+,也可以是中性的原子,如羰基镍〔Ni(CO)4〕中的Ni。周 期表中所有的金属元素都可作为中心原子,但以过渡金属最易形成配合物。配位体可以是中性分子,如〔Cu(NH3)4〕SO4中的NH3,也可以是带电的离子,如亚铁氰化钾K4〔Fe(CN)6〕中的CN-。与中心原子相结合的配位体的总个数称为配位数,例如K4〔Fe(CN)6〕中Fe2+的配位数是6 。中心原子和配位体共同组成配位本体(又称内界),在配合物的分子式中,配位本体被括在方括弧内,如〔Cu(NH3)4〕SO4中,〔Cu(NH3)4〕2+就是配位本体 。它可以是中性分子,如〔Ni(CO)4〕;可以是阳离子,如[Cu(NH3)4〕2+ ;也可以是阴离子,如〔Fe(CN)6〕4-。带电荷的配位本体称为配离子。 是外界。中心原子可以是带电的离子,如〔Cu(NH3)4〕SO4中的Cu2+,也可以是中性的原子,如羰基镍〔Ni(CO)4〕中的Ni。周 期表中所有的金属元素都可作为中心原子,但以过渡金属最易形成配合物。配位体可以是中性分子,如〔Cu(NH3)4〕SO4中的NH3,也可以是带电的离子,如亚铁氰化钾K4〔Fe(CN)6〕中的CN-。与中心原子相结合的配位体的总个数称为配位数,例如K4〔Fe(CN)6〕中Fe2+的配位数是6 。中心原子和配位体共同组成配位本体(又称内界),在配合物的分子式中,配位本体被括在方括弧内,如〔Cu(NH3)4〕SO4中,〔Cu(NH3)4〕2+就是配位本体 。它可以是中性分子,如〔Ni(CO)4〕;可以是阳离子,如[Cu(NH3)4〕2+ ;也可以是阴离子,如〔Fe(CN)6〕4-。带电荷的配位本体称为配离子。命名方法 ①命名配离子时,配位体的名称放在前,中心原子名称放在后。②配位体和中心原子的名称之间用“合”字相连。③中心原子为离子者,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态。④配位数用中文数字在配位体名称之前。⑤如果配合物中有多种配位体,则它们的排列次序为:阴离子配位体在前,中性分子配位体在后;无机配位体在前,有机配位体在后。不同配位体的名称之间还要用中圆点分开。根据以上规则,〔Cu(NH3)4〕SO4称硫酸四氨合铜(Ⅱ),〔Pt(NH3)2Cl2〕称二氯·二氨合铂(Ⅱ),K〔PtCl3(C2H4)〕称三氯·(乙烯)合铂(Ⅱ)酸钾。实际上,配合物还常用俗名,如K4〔Fe(CN)6〕称黄血盐 ,K3〔Fe(CN)6〕称赤血盐 ,Fe4〔Fe(CN)6〕3称普鲁士蓝。 价键 在配合物中,中心原子与配位体之间共享两个电子,组成的化学键称为配位键,这两个电子不是由两个原子各提供一个,而是来自配位体原子本身,例如〔Cu(NH3)4〕SO4中,Cu2+与NH3共享两个电子组成配位键,这两个电子都是由N原子提供的 。形成配位键的条件是中心原子必须具有空轨道,而过渡金属原子最符合这一条件。 类型 按配位体分类,可有 :①水合配合物。为金属离子与水分子形成的配合物,几乎所有金属离子在水溶液中都可形成水合配合物,如〔Cu(H2O)4〕2+、〔Cr(H2O)6〕3+。②卤合配合物。金属离子与卤素(氟、氯、溴、碘)离子形成的配合物,绝大多数金属都可生成卤合配合物,如K2〔PtCl4〕、Na3〔AlF6〕。③氨合配合物。金属离子与氨分子形成的配合物,如〔Cu(NH3)4〕SO4。④氰合配合物。金属离子与氰离子形成的配合物 ,如K4〔Fe(CN)6〕。⑤金属羰基合物。金属与羰基(CO)形成的配合物。如〔Ni-(CO)4〕。 按中心原子分类,可有:①单核配合物。只有一个中心原子,如K2〔CoCl4〕。②多核配合物。中心原子数大于1,如〔(H3N)4Co(OH)(NH2)Co(H2NCH2CH2NH2)2〕Cl4。 按成键类型分类,可有:①经典配合物。金属与有机基团之间形成 σ配位键,如〔Al2(CH3)6〕。②簇状配合物。至少含有两个金属作为中心原子 ,其中还含有金属-金属键,如〔W6(Cl12)Cl6〕。③含不饱和配位体的配合物。金属与配位体之间形成π-σ键或π-π*反馈键 ,如K〔PtCl2(C2-H4)〕。④夹心配合物。中心原子为金属,配位体为有机基团,金属原子被夹在两个平行的碳环体系之间,例如二茂铁〔Fe(C5H5)2〕。⑤穴状配合物。配位体属于巨环多齿的有机化合物,如具有双环结构的N(CH2CH2OCH2CH2OCH2CH2)3N,它们与碱金属和碱土金属形成穴状配合物。 按学科类型分类,可有:①无机配合物。中心原子和配位体都是无机物。②有机金属化合物。金属与有机物配位体之间形成的配合物。③生物无机化合物。生物配位体与金属形成的配合物,如金属酶、叶绿素、维生素B12。 稳定性 通常,配位化合物的稳定性主要指热稳定性和配合物在溶液中是否容易电离出其组分(中心原子和配位体)。配位本体在溶液中可以微弱地离解出极少量的中心原子(离子)和配位体 ,例如〔Cu(NH3)4〕2+可以离解出少量的Cu2+和NH3: 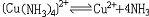 配位本体在溶液中的离解平衡与弱电解质的电离平衡很相似,也有其离解平衡常数,称为配合物的稳定常数K: 配位本体在溶液中的离解平衡与弱电解质的电离平衡很相似,也有其离解平衡常数,称为配合物的稳定常数K: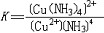 K越大,配合物越稳定,即在水溶液中离解程度小。 K越大,配合物越稳定,即在水溶液中离解程度小。配合物在溶液中的稳定性与中心原子的半径、电荷及其在周期表中的位置有关。过渡金属的核电荷高,半径小,有空的d轨道和自由的d电子,它们容易接受配位体的电子对,又容易将d电子反馈给配位体。因此,它们都能形成稳定的配合物。碱金属和碱土金属恰好与过渡金属相反,它们的极化性低,具有惰性气体结构,形成配合物的能力较差,它们的配合物的稳定性也差。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条