4) preparation and determination methods


制备和检测
1.
In this paper, the physical and chemical characters?preparation and determination methods and biological functions are summarized.
本文就乳源阿片肽的理化特性、制备和检测方法以及生理功能进行了综述。
5) separation and preparation


分离和制备
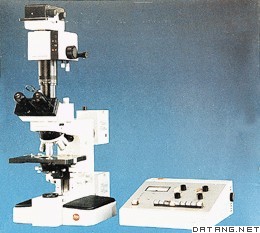
补充资料:光学和电子显微镜样品制备
| 光学和电子显微镜样品制备 optical and electron microscopy,preparation of specimens for 将生物材料制成适于在显微镜下观察的薄片的技术。 光学显微制片技术 光学显微镜制片首先要尽量保持生物材料的天然状态,避免赝像、变形和失真,因此须将生物材料做固定处理;制片必须薄而透明,才能在光学显微镜下成像,除将材料切成薄片或通过轻压或其他手段使之分散外,还需采用其他方法使它透明和染色,以便更好地观察到结构的细节。需长期保存的制片,还应进行脱水和封固。 显微制片法一般包括切片法、整体封片法、涂片法和压片法4类。①切片法。光学显微镜的切片厚度在2~25微米之间,一般动植物材料的切片以厚10微米左右为合适。切片法根据包埋剂的不同而有所不同。常用的是石蜡切片法、棉胶切片法、冰冻切片法、乙二醇甲基丙烯酸脂法(简称GMA法)。石蜡切片法包括固定、包埋、切片、染色、脱水和封固等步骤。关键是把生物材料用石蜡包埋,以石蜡为支持物,把浸在蜡块中的生物材料切成理想的薄片。操作过程为:固定→水洗→从低浓度逐级到高浓度酒精脱水→二甲苯透明→浸蜡→包埋→切片→贴片→二甲苯脱蜡→逐级从高浓度到低浓度酒精处理,最后过渡到水→染色→逐级从低浓度到高浓度酒精脱水→二甲苯透明→树脂胶封固。其中的基本步骤在各种制片技术中都是相同的。②整体封片法。用于单细胞、微小生物体或分散的器官的整装制片方法。此法也需要经过固定、染色、脱水、透明和封固各个步骤。草履虫和昆虫口器制片即用此法。③涂片法。把易于分散的生物标本涂布在载玻片上的制片方法。血液涂片便是一例。④压片法。将天然的、易于分散的组织或经过处理后易于分散的组织,如动物的精母细胞、根尖细胞等放在载玻片上、再加盖玻片,用力压碎组织,使细胞或细胞内的结构铺展成一层的制片方法。压片法常用于观察染色体,通常用醋酸洋红、地衣红和石炭酸复红染色。
透射电子显微镜制片技术 其基本要求是:①尽可能保持材料的结构和某些化学成分生活时的状态。②材料的厚度一般不宜超过1000埃。组织和细胞,必须制成薄切片,以获得较好的分辨率和足够的反差。③采用各种手段,如电子染色、投影、负染色等来提高生物样品散射电子的能力,以获得反差较好的图像。 样品制备的方法随生物材料的类型以及研究目的而各有不同。对生物组织和细胞等,一般多用超薄切片技术,将大尺寸材料制成适当大小的超薄切片,并且利用电子染色、细胞化学、免疫标记及放射自显影等方法显示各种超微结构、各种化学物质的部位及其变化。对生物大分子(蛋白质、核酸)、细菌、病毒和分离的细胞器等颗粒材料,常用投影、负染色等技术以提高反差,显示颗粒的形态和微细结构。此外还有以冷冻固定为基础的冷冻断裂——冰冻蚀刻、冷冻置换、冷冻干燥等技术。 扫描电子显微镜样品制备技术 扫描电镜以观察样品的表面形态为主。扫描电镜样品的制备,必须满足以下要求:①保持完好的组织和细胞形态。②充分暴露欲观察的部位。③良好的导电性和较高的二次电子产额。④保持充分干燥的状态。 某些含水量低且不易变形的生物材料,可以不经固定和干燥而在较低加速电压下直接观察,如动物毛发、昆虫、植物种子、花粉等,但图像质量差,而且观察和拍摄照片时须尽可能迅速。对大多数的生物材料,则应首先采用化学或物理方法固定,脱水和干燥,然后喷镀碳与金属以提高材料的导电性和二次电子产额。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条