1) titrimetric(volumetric)analysis


滴定(容量)分析
2) volumetric titration


容量滴定
3) acidimetric analysis


酸量滴定分析
4) imetric analysis


碱量滴定分析
5) acidimetric analysis


酸量滴定分析法
6) titrimetry
[tai'trimitri]


滴定分析
1.
There are some shortcomings in titrimetry experiment in current analytical chemistry teaching materials.
目前的分析化学实验教材中关于滴定分析的实验指导还存在着一些不足,特别是对有些关键技术的指导存在着说的不清、说的不到位的情况,有必要对相关教材在修定时进行必要的补充与完善。
2.
The calculation methods in the chemical titrimetry after the promulgation of the legal unit of measurement are mainly introduced.
主要介绍法定计量单位颁布以后,化学滴定分析的计算方法,同时推荐一种更具实用意义的通用计算方法,并对其推导过程进行了详细的阐述。
补充资料:容量分析
| 容量分析 volumetric analysis 将一种已知准确浓度的试剂溶液滴加到被测物质的试液中,根据完成化学反应所消耗的试剂量来确定被测物质的量的化学分析方法。又称滴定分析。容量分析所用的仪器简单,还具有方便、迅速、准确的优点,特别适用于常量组分测定和大批试样的例行分析。 能用于容量分析的化学反应必须符合一定条件,除反应应该进行得比较完全和反应速率要快外,其中最重要的是反应物间要有确定的化学计量关系,因为这是计算分析结果的依据。滴定操作应进行到化学计量点(也称等当点)时结束。但这时往往没有可被觉察的外部特征,于是,常常需要加入一种指示剂,它能在等当点附近发生颜色变化,以指示滴定终了,此称为滴定终点。常用的用目视法确定终点的容量分析方法有酸碱滴定法、络合滴定法、氧化还原滴定法、沉淀滴定法和非水滴定法(在有机溶剂中进行滴定)等。也可以用仪器测定滴定过程中体系的物理性质的变化来确定终点,如测定电位、电流、光度的电位滴定、安培滴定和光度滴定等。 滴定的方式有:①直接滴定。如果反应有确定的计量关系,完全度高,速度快,又有适当方法确定终点,最好采用直接滴定。②置换滴定。以K2Cr2O7与Na2S2O3的反应为例,由于K2Cr2O7的氧化性较强,它不但能把 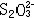 氧化为 氧化为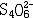 ,还能将 ,还能将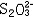 部分地氧化为 部分地氧化为 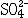 ,这样反应就没有确定的计量关系,不能直接滴定。如果在酸性的 K2Cr2O7溶液中加入过量的KI,就可定量地置换出氧化性弱的I2,而I2和 ,这样反应就没有确定的计量关系,不能直接滴定。如果在酸性的 K2Cr2O7溶液中加入过量的KI,就可定量地置换出氧化性弱的I2,而I2和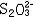 反应有确定的计量关系,就可以用Na2S2O3滴定置换出来的I2。总的效果仍是 反应有确定的计量关系,就可以用Na2S2O3滴定置换出来的I2。总的效果仍是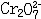 氧化了 氧化了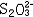 。③返滴定。盐酸能与碳酸钙反应,但恰好加入反应所需的盐酸时,碳酸钙固体并不能完全溶解,因此不能直接滴定。如果先加入过量HCl,加热使CaCO3完全溶解,并除去CO2,再用NaOH返滴定HCl,就可测定碳酸钙。④间接滴定。Ca2+在溶液中没有价态变化,不能用氧化还原滴定法直接测定。若先将Ca2+沉淀成为 CaC2O4,过滤洗涤后,溶于盐酸,生成H2C2O4,可用高锰酸钾滴定。置换滴定、返滴定、间接滴定大大扩大了容量分析的应用。 。③返滴定。盐酸能与碳酸钙反应,但恰好加入反应所需的盐酸时,碳酸钙固体并不能完全溶解,因此不能直接滴定。如果先加入过量HCl,加热使CaCO3完全溶解,并除去CO2,再用NaOH返滴定HCl,就可测定碳酸钙。④间接滴定。Ca2+在溶液中没有价态变化,不能用氧化还原滴定法直接测定。若先将Ca2+沉淀成为 CaC2O4,过滤洗涤后,溶于盐酸,生成H2C2O4,可用高锰酸钾滴定。置换滴定、返滴定、间接滴定大大扩大了容量分析的应用。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条