1) amino acids reduced Schiff base


氨基酸还原席夫碱
2) amino-acid schiff base


氨基酸席夫碱
1.
A new amino-acid Schiff base,1-phenyl-3-methyl-4-benzoyl-5-pyrazolone-β-alanine(HL) and its UO_(2)(Ⅱ),Cu(Ⅱ),Ni(Ⅱ) and Zn(Ⅱ) complexes have been synthesized.
合成了新氨基酸席夫碱试剂1-苯基-3-甲基-4-苯甲酰基吡唑啉酮-5缩β-丙氨酸(HL)及其UO22+,Cu(Ⅱ),Ni(Ⅱ)和Zn(Ⅱ)配合物。
3) amino acid schiff base


氨基酸席夫碱
1.
In this study,a number of amino acid schiff bases from vanillin and amino acid have been synthesized under microwave irradiation coupled with solvent-free condition,which proves to be simple and efficient.
氨基酸席夫碱是制备特殊生物活性物质的重要中间体。
2.
In order to search for novel high activity and low toxicity antitumor drugs, thirteen novel 5-fluorouracil derivatives containing amino acid Schiff base were synthesized via the condensation reactions of N 1-(2-furanidyl)-N 3-(4-bromobutyl)-5-fluorouracil and amino acid Schiff bases.
以N1-(2-四氢呋喃烷基)-5-氟尿嘧啶为原料,与1,4-二溴丁烷反应,得到N1-(2-四氢呋喃烷基)-N3-(4-溴丁基)-5-氟尿嘧啶(2),最后与氨基酸席夫碱的钾盐缩合,得到13个新的目标化合物3。
4) reduced Schiff base


还原席夫碱
5) reduced bis-Schiff base


还原双席夫碱
1.
A reduced bis-Schiff base guest containing pyridyl, N,N′-bis(4-pyridylmethyl)-1,6-hexanediamine (C6N4), has been synthesized from 4-pyridinecarboxaldehyde and 1,6-hexanediamine.
以4-吡啶甲醛和1,6-己二胺为原料,合成了含吡啶基的还原双席夫碱客体N,N′-二(4-吡啶基甲基)-1。
6) amino acid-salicylaldehyde schiff base


氨基酸水扬醛席夫碱
补充资料:酸碱理论
| 酸碱理论 acid-base theory 阐明酸、碱本身以及酸碱反应的本质的各种理论。最早提出酸、碱概念的是英国R.玻意耳。法国A.L.拉瓦锡又提出氧是所有酸中普遍存在的和必不可少的元素,英国H.戴维以盐酸中不含氧的实验事实证明拉瓦锡的看法是错误的,戴维认为:“判断一种物质是不是酸,要看它是否含有氢。”这个概念带有片面性,因为很多有机化合物和氨都含有氢,但并不是酸。德国J.von李比希弥补了戴维的不足,为酸和碱下了更科学的定义:“所有的酸都是氢的化合物,但其中的氢必须是能够很容易地被金属所置换的。碱则是能够中和酸并产生盐的物质。”但他不能解释为什么有的酸强,有的酸弱。这一问题为瑞典S.A.阿伦尼乌斯解决。 阿伦尼乌斯酸碱理论 在阿伦尼乌斯电离理论的基础上提出的酸碱理论是:“酸、碱是一种电解质,它们在水溶液中会离解,能离解出氢离子的物质是酸;能离解出氢氧根离子的物质是碱。”由于水溶液中的氢离子和氢氧根离子的浓度是可以测量的,所以这一理论第一次从定量的角度来描写酸碱的性质和它们在化学反应中的行为,指出各种酸碱的电离度可以大不相同,有的达到90%以上,有的只有1%,于是就有强酸和弱酸;强碱和弱碱之分。强酸和强碱在水溶液中完全电离;弱酸和弱碱则部分电离。阿伦尼乌斯还指出,多元酸和多元碱在水溶液中分步离解,能电离出多个氢离子的酸是多元酸;能电离出多个氢氧根离子的碱是多元碱,它们在电离时都是分几步进行的。这一理论还认为酸碱中和反应乃是酸电离出来的氢离子和碱电离出来的氢氧根离子之间的反应: H++OH-  H2O。 H2O。阿伦尼乌斯酸碱理论也遇到一些难题,如:①在没有水存在时,也能发生酸碱反应,例如氯化氢气体和氨气发生反应生成氯化铵,但这些物质都未电离。②将氯化铵溶于液氨中,溶液即具有酸的特性,能与金属发生反应产生氢气,能使指示剂变色,但氯化铵在液氨这种非水溶剂中并未电离出氢离子。③碳酸钠在水溶液中并不电离出氢氧根离子,但它却是一种碱 。要解决这些问题 ,必须使酸碱概念脱离溶剂(包括水和其他非水溶剂)而独立存在。其次酸碱概念不能脱离化学反应而孤立存在,酸和碱是相互依存的,而且都具有相对性。解决这些难题的是丹麦J.N.布仑斯惕和英国T.M.劳里,他们于1923年提出酸碱质子理论。 酸碱质子理论 布仑斯惕和劳里提出的酸碱定义是:“凡是能够释放出质子(H+)的物质,无论它是分子、原子或离子,都是酸; 凡是能够接受质子的物质,无论它是分子、原子或离子,都是碱。”酸和碱之间存在以下关系: 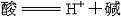 上式表明酸和碱是相互依赖的。在以下反应中: 上式表明酸和碱是相互依赖的。在以下反应中:HCl+H2O  H3O++Cl-HCl和H3O+都能够释放出质子,它们都是酸: H3O++Cl-HCl和H3O+都能够释放出质子,它们都是酸:HCl  H++Cl- H++Cl-H3O+  H++H2OH2O和Cl-都能够接受质子,它们都是碱: H++H2OH2O和Cl-都能够接受质子,它们都是碱:H2O+H+  H3O+ H3O+Cl-+H+  HCl上述反应称为质子传递反应,可用一个普遍反应式表示: HCl上述反应称为质子传递反应,可用一个普遍反应式表示:酸1+碱2  酸2+碱1当一种分子或离子失去质子起着酸的作用的同时,一定有另一种分子或离子接受质子起着碱的作用。酸1和碱1或酸2和碱2称为共轭酸对。 酸2+碱1当一种分子或离子失去质子起着酸的作用的同时,一定有另一种分子或离子接受质子起着碱的作用。酸1和碱1或酸2和碱2称为共轭酸对。酸碱质子理论的优点是:①扩大了酸的范围。只要能够释放出质子的物质,不论它是在水溶液中;或是非水溶剂 ;或是气相反应;或是熔融状态,它们都是酸,例如NH4+、HCO3-、HSO4-、HS-、H2PO4-、HPO42-、H2O酸。②扩大了碱的范围。NH3和Na2CO3都能接受质子,全是碱: 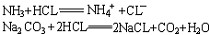 于是,F-、Cl-、Br-、I-、HSO4-、SO42-等都可算是碱。③一种物质是酸还是碱,是由它在酸碱反应中的作用而定。HCO3-与NaOH反应时放出质子,此时它是一种酸:HCO3-+NaOH 于是,F-、Cl-、Br-、I-、HSO4-、SO42-等都可算是碱。③一种物质是酸还是碱,是由它在酸碱反应中的作用而定。HCO3-与NaOH反应时放出质子,此时它是一种酸:HCO3-+NaOH Na++CO32-+H2O,HCO3-与HCl反应时,它又接受质子,则是一种碱: Na++CO32-+H2O,HCO3-与HCl反应时,它又接受质子,则是一种碱: 由此可见,酸和碱的概念具有相对性。 由此可见,酸和碱的概念具有相对性。当然,酸碱质子理论也有解释不了的问题,例如,无法说明下列反应是酸碱反应: CaO+SO3  CaSO4在这个反应中SO3显然是酸,但它并未释放质子;CaO显然是碱,但它并未接受质子。又如实验证明了许多不含氢的化合物(它们不能释放质子) 如AlCl3、BCl3、SnCl4都可以与碱发生反应,但酸碱质子理论无法解释它们是酸。 CaSO4在这个反应中SO3显然是酸,但它并未释放质子;CaO显然是碱,但它并未接受质子。又如实验证明了许多不含氢的化合物(它们不能释放质子) 如AlCl3、BCl3、SnCl4都可以与碱发生反应,但酸碱质子理论无法解释它们是酸。路易斯酸碱理论 1923年美国G.N.路易斯指出 ,没有任何理由认为酸必须限定在含氢的化合物上,他的这种认识来源于氧化反应不一定非有氧参加。路易斯是共价键理论的创建者,所以他更倾向于用结构的观点为酸碱下定义:“碱是具有孤对电子的物质,这对电子可以用来使别的原子形成稳定的电子层结构。酸则是能接受电子对的物质,它利用碱所具有的孤对电子使其本身的原子达到稳定的电子层结构。”这一理论很好地解释了一些不能释放出质子的物质也是酸;一些没有接受质子的物质也是碱。如CaO与SO3的反应可解释如下:  在这一反应中,CaO并未接受质子,但它具有孤对电子,这对电子可以用来使SO3中的硫原子达到稳定的8电子层结构,所以CaO是碱。SO3在反应中虽然没有释放质子 ,但其中的硫原子能够接受CaO中氧原子的孤对电子而达到稳定的8电子层结构,所以SO3是一种酸。 在这一反应中,CaO并未接受质子,但它具有孤对电子,这对电子可以用来使SO3中的硫原子达到稳定的8电子层结构,所以CaO是碱。SO3在反应中虽然没有释放质子 ,但其中的硫原子能够接受CaO中氧原子的孤对电子而达到稳定的8电子层结构,所以SO3是一种酸。路易斯酸碱理论解释了许多有机反应也是酸碱反应,例如CH3+、C2H5+、CH3CO+都是酸,分别与碱H+、OH-、C2H5O-结合成加合物CH4、C2H5OH、CH3COOC2H5。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条